Scheda malattia
Neutropenie Congenite da mutazioni rare
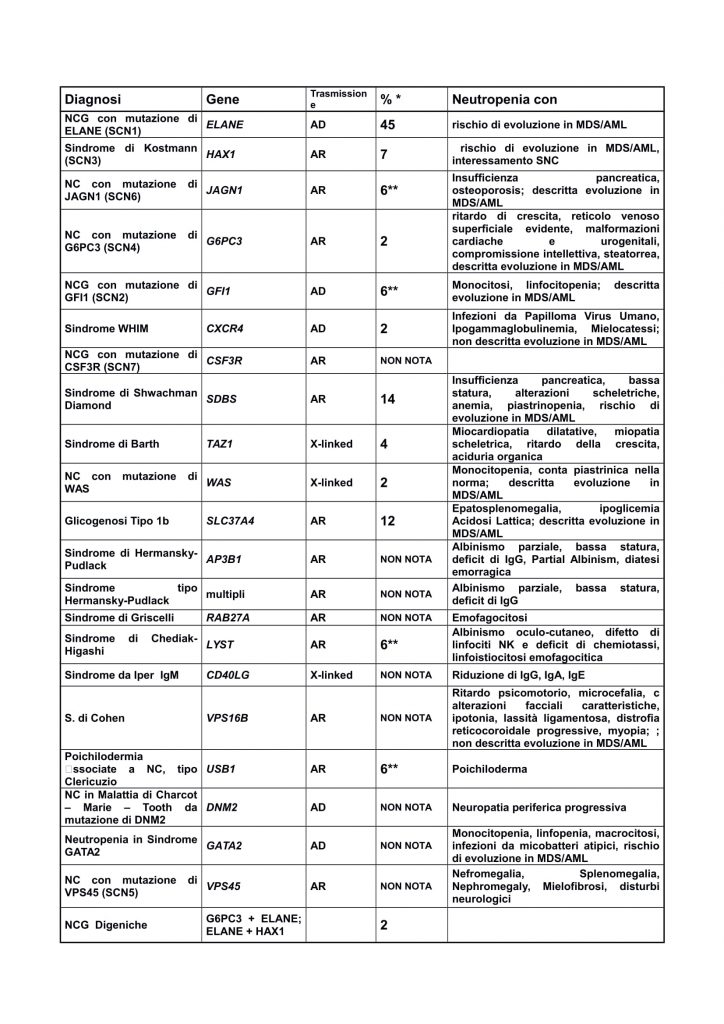
La neutropenia congenita grave (NCG) oltre che a mutazione dei geni ELANE (SCN1) e HAX1 (SCN3) precedentemente descritte, può essere causata anche ad altre rare mutazioni a diversa trasmissione genetica che causano NCG o NC isolata o in associazione ad alterazioni non ematologiche. Negli ultimi 10 anni sono stati identificati almeno 24 geni associati a neutropenia congenita, anche se in circa il 20% dei casi di NC non è stato ancora identificato un difetto genetico responsabile della malattia (Cfr Tavola 1). Sono stati segnalati casi isolati di mutazioni multigeniche (G6PC3 e Elane; Elane e HAX1)
Tavola 1: Principali alterazioni genetiche associate a NC:
Neutropenia da mutazione di GFI1 (SCN2):
Neutropenia congenita grave (N< 500/mm3), associata a monocitosi e linfopenia a trasmissione autosomica dominante, legata a mutazione del protoonogene GFI1 (Growth factor independent 1) localizzato sul cromosoma 1p22a. Presente blocco maturativo della granulopoiesi a livello dei promielociti. Precoce inizio di infezioni batteriche gravi. Descritta la evoluzione in MDS/AML)
Neutropenia da mutazione di G6PC3 (SCN4):
Neutropenia congenita grave, a trasmissione autosomica recessiva, descritta nel 2009, legata a mutazione del gene G6PC3, sul cromosoma17q21 che codifica per la Subunità Catalitica 3 della Glucosio 6 Fosfatasi. Caratteristiche riportate: ritardo di crescita, reticolo venoso superficiale evidente, malformazioni cardiache, malformazioni urogenitali, compromissione intellettiva, diarrea cronica e steatorrea, malattia di Chron. Non sono presenti alterazioni del metabolismo del glucosio. Presente blocco maturativo della serie mieloide nel MO. Rara la evoluzione in MDS/AML; la maggior parte dei pazienti risponde al trattamento con basse dosi di G-CSF.
Neutropenia da mutazione di VPS45A (SCN5):
Neutropenia congenita grave, a trasmissione autosomica recessiva, con neutropenia e disfunzione dei neutrofili associata a mielofibrosi e ematopoiesi extramidollare renale con piastrinopenia, anemia e eritroblasti allo striscio periferico. Possono essere presenti anche disturbi di accrescimento, epatomegalia. La neutropenia non risponde al G-CSF
Neutropenia da mutazione di JAGN1 (SCN6):
Neutropenia congenita grave a trasmissione autosomica recessiva causata da mutazione del gene JAGN1 (Jagunal Homolog 1) sul cromosoma 3p25, implicato nella corretta glicosilazione di glicoproteine nel reticolo endoplasmico. Accanto alla neutropenia grave, alle infezioni batteriche ad esordio precoce, sono presenti anche scarso accrescimento statuto ponderale e insufficienza pancreatica. Presente blocco maturativo della serie mieloide nel MO. La risposta al G-CSG è scarsa/assente. Descritta la evoluzione in MDS/AML.
Neutropenia da mutazione di CSF3R (SCN7):
Neutropenia congenita grave isolata, legata a mutazione gel gene che codifica per il Recettore del G-CSF (trasmissione AR), con insorgenza di infezioni ricorrenti dalla prima infanzia; presente blocco maturativo della serie mieloide nel mieloaspirato; i pazienti non rispondono al trattamento con G-CSF; in alcuni casi risposta al trattamento con GM-CSF; non descritta progressione in MDS/AML
Neutropenia da mutazione di CXCR4:
Mutazioni del gene CXCR4 (2q21) sono responsabili della sindrome WHIN (verruche, ipogammaglobuinemia, infezioni e mielocatessi). Si tratta di un deficit immunitario congenito, a trasmissione autosomica dominante legata a mutazioni con guadagno di funzione del gene CXCR4, che codifica per un recettore delle chemochine espresso sui leucociti maturi che controlla l’adesione e l’insediamento cellulare nel midollo osseo attraverso il legame con il ligando SDF1 presente nelle cellule stromali del midollo. La attivazione prolungata del recettore, conseguente alla mutazione, causa la ritenzione dei neutrofili e di altri leucociti nel midollo (mielocatessi). Il mieloaspirato presenta aumento del pool dei granulociti maturi, senza blocco maturativo.
Neutropenia da mutazione di WAS:
(NCG X-linked/ SCNX). Variante della Sindrome di Wiscott Aldricht, attribuita a mutazione con guadagno di funzione nel GTPase binding domain della proteina WAS. La proteina mutata attivata in modo costituzionale causerebbe alterata polimerizzazione della actina con apoptosi durante la maturazione delle cellule mieloidi, responsabile della neutropenia congenita. Presente blocco maturativo della serie mieloide nel mieloaspirato; possibile evoluzione in MDS/AML Nella S. di Wiscott Aldrich “tradizionale”, le mutazioni con perdita di funzione del gene WAS portano a livelli/ridotta attività della WASp con diminuzione della polimerizzazione della actina.
Neutropenia Ciclica (NCicl):
Neutropenia costituzionale caratterizzata da fluttuazione regolare (ciclo da 21 a 28 giorni) dei neutrofili associata a fluttuazioni meno importanti, ma tuttavia presenti, di monociti, piastrine, reticolociti e linfociti.E’ una malattia rara, a trasmissione autosomica dominante, legata a mutazioni del gene ELANE con prevalenza stimata a 2 casi su 1.000.000. Esiste una sostanziale sovrapposizione tra le mutazioni di ELANE che causano NCG e quelle che causano NCicl, così che la identificazione del genotipo non è sufficiente a stabilire la diagnosi clinica, che si basa ancora sulla documentazione del cycling dei neutrofili con la esecuzione di emocromi seriati (consigliati ancora 3 emocromi / settimana x 6 settimane). I pazienti, al nadir della conta dei neutrofili, presentano marcata suscettibilità alle infezioni, alle afte della mucosa orale e ai dolori addominali e rischio di sepsi da C. Difficile.I pazienti con neutropenia ciclica rispondono bene al trattamento continuativo con G-CSF, che non annulla il cycling dei neutrofili, ma aumenta il numero assoluto dei neutrofili, accorcia la periodicità del ciclo anche fino a 14 gg e riduce il rischio infettivo.Nella fase di neutropenia il mieloaspirato mostra un blocco maturativo delle cellule mieloidi a livello dei promielociti.Recentemente sono stati descritti isolati casi con evoluzione clonale, con un meccanismo simile a quanto descritto nei casi di NCG, pertanto, anche nei pazienti con Neutropenia Ciclica è consigliabile effettuare un attento monitoraggio della evoluzione clonale.